欢迎进入飞诺美网站!
 24小时热线电话:400-606-8099
24小时热线电话:400-606-8099
欢迎进入飞诺美网站!
 24小时热线电话:400-606-8099
24小时热线电话:400-606-8099
 放射性配体治疗药物在临床前生物样本的LC-MS/MS分析研究进展
放射性配体治疗药物在临床前生物样本的LC-MS/MS分析研究进展 更新时间:2025-06-20
更新时间:2025-06-20 点击次数:663
点击次数:663
癌症作为全球死亡的主要原因之一,根据美国癌症协会的数据,癌症仍然是美国死亡的第二大杀手,在2022年导致近600万人死亡。在过去的几十年里,科学家和医疗专业人员一直在积极开展癌症研究,寻求新的治疗手段和预防措施。包括但不限于手术、化疗、放疗、靶向治疗、基因治疗和免疫治疗。而放射性配体疗法(Radioligand therapy, RLT)作为一种新型治疗手段,近年来在癌症的诊断、治疗和监测方面展现出了显著的发展势头。作为晚期癌症患者的一种精准核医学治疗形式,RLT利用具有放射性的靶向药物,即放射性配体,特异性结合癌细胞上所表达的受体,再以直接和精确的方式通过射线杀死癌细胞,同时保留周围的健康组织。RLT的一个成功例子是Pluvicto(177Lu-PMSA-617),它是2022年被批准的第一个前列腺特异性膜抗原靶向的放射性配体疗法,在前列腺癌患者中展现了显著的临床疗效。
放射性配体由四个部分组成:放射性同位素、靶向配体、连接子和螯合剂。高能放射性同位素,如α和β发射体,提供导致DNA损伤的辐射,通常用于癌症治疗,另一方面,γ射线因其能量非常微弱,但穿透能力强的特点适合用于开发SPECT(单光子发射计算机断层成像)与PET(正电子发射断层成像)用放射性诊断药物。放射性同位素与螯合剂形成的金属螯合物通过小分子连接子与靶向配体连接,而DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)因其对许多放射性同位素具有高亲和力和稳定性而被广泛用作螯合剂。
在核药临床前开发中,研究人员往往使用冷药(放射性治疗药物的非放射性或衰变形式,例如,175Lu)作为热药(具有放射性,例如177Lu)替代物,在相对低的剂量水平下研究RLT候选药物的安全性。临床前安全性研究中使用的供试品包含冷药(放射性治疗药物的非放射性或衰变形式,即ligand-linker-chelator with nonradioactive metal)和游离配体(即ligand-linker-chelator without metal)。在文献“LC−MS/MS Bioanalysis of Radioligand Therapeutic Drug Candidate for Preclinical Toxicokinetic Assessment"的报道中,诺华的研究人员开发了一种高选择性和高灵敏度的旨在检测动物血浆样品中游离配体(NVS001)和冷药(175Lu-NVS001)的LC−MS/MS方法。

一般来说,具有螯合结构的化合物在液相分析往往容易与仪器不锈钢管路或者色谱柱不锈钢管壁发生作用,导致峰形异常、灵敏度下降或重现性欠佳等问题,除此以外,多肽也容易与样品容器或者内源性蛋白发生非特异性吸附。因而文献中所提到的分析挑战有:
未鳌合配体药物NVS001灵敏度差
未鳌合配体药物NVS001易与内源性金属离子如钾形成复合物
66Ga标记的内标在样品提取和分析过程中出现66Ga离子流失
待测物在低浓度不稳定
血样提取样品中内标响应不一致
EDTA在液相分析中作为流动相添加剂中的一种,往往用作类似金属屏蔽剂的作用,来改善具有螯合结构的化合物峰形和灵敏度问题,在该研究中,我们不仅可以看到在流动相中做了类似的添加,而且在样品的前处理过程中同样使用到了EDTA。
色谱柱:C18, 100 × 2.1 mm 1.8 μm
流动相A:40 mM碳酸氢铵水溶液(含20 µM EDTA和0.04%氨水)
流动相B:甲醇
柱温:40℃
流速:0.6 mL/min
进样体积:10~20 µL (EDTA和氨水添加到乙腈/甲醇 (50:50, V/V)洗针液以减少残留)
检测器:LC−MS/MS 正离子模式
NVS001: m/z 443.9 → 292.3
175Lu-NVS001: 529.9 → 421.3
66Ga-NVS001: 476.9 → 368.3

NVS001和175Lu-NVS001 (0.2 mg/mL) 储备液配置:乙腈/DMSO (30/70, V/V),用甲醇/水 (50/50, V/V, 含0.1%甲酸和10 µM EDTA )作稀释剂配置0.01~5 µg/mL溶液
66Ga-NVS001内标工作液 (15 ng/mL) :将内标储备液 (0.1mg/mL)用甲醇/水 (50/50, V/V, 含0.1%甲酸和10 µM EDTA )稀释配置
上述所有溶液均置于PP管中于2-8℃保存
校准曲线和QC样品配置:将适量浓度为0.01~5 µg/mL的NVS001和175Lu-NVS001标液与1%磷酸处理的血浆样品按1:24 (V/V) 分别配置成0.500, 1.00, 3.00, 10.0, 25.0, 100, 200, 250 ng/mL的校准曲线样品;QC样品浓度分别为0.500, 1.50, 10.0, 100, 190 ng/mL;所有QC样置于PP小瓶中≤−70 °C保存
所有校准标样,QC样和待测样品均置于低温(wet ice)中解冻和处理
向96孔板中分别加入25 µL空白血浆,校准标样,QC样和待测样品;再向除基质空白样以外的所有孔中加入25 µL 66Ga-NVS001内标工作液 (15 ng/mL) ;基质空白样则加入25 µL甲醇/水 (50/50, V/V, 含0.1%甲酸和10 µM EDTA )
向所有孔中加入300 µL蛋白沉淀试剂 (25:25:50 [V/V/V], 丙酮/乙腈/甲醇含0.2%甲酸和20 µM Na2EDTA ,涡旋10min后1640×g 离心5min
取300 µL上清液转移至含10 µL 异丙醇/丙二醇 (50:50 [V/V]),涡旋后于30℃下氮吹至尽干,最后用150 µL甲醇/水 (25:75 (V/V) 含0.1%甲酸和10 µM Na2EDTA),涡旋10min后进样分析
沉淀试剂优化过程:
纯乙腈作为沉淀试剂无法获得良好的NVS001 和 175Lu-NVS001回收率
替换为纯甲醇可实现理想的回收率,但同时带来基线背景升高和干扰峰的问题
Na2EDTA和甲酸的加入可有效防止内标工作液中66Ga的丢失
犬血样品提取后内标响应偏差较大(大鼠血样表现正常),经过优化,25%丙酮的加入和至少10min的蛋白沉淀涡旋有助于确保内标响应的一致性;同时,将Na2EDTA和甲酸的添加浓度由10 µM和0.1%分别增加至20 µM和0.2%有助于消除由上述操作带来的内标66Ga流失的问题

NVS001: m/z 443.9 → 292.3进溶剂标样或者血浆提取样品响应都不及预期,进一步考察显示,NVS001易与钾离子形成复合物 (K-NVS001, m/z 462.9 → 310.3 );中浓度QC提取样品,含NVS001和175Lu-NVS001各100 ng/mL,流动相未添加20 µM Na2EDTA可观察到明显的K-NVS001峰,175Lu-NVS001和66Ga-NVS001的响应并未受到添加Na2EDTA的影响(Figure 2)。

通常DOTA和大多数三价金属离子如GaIII and LuIII的配合物在室温下是稳定的,但是在以下情形易出现金属离子的丢失:
与内源性金属离子发生交换
碱性条件下易形成氢氧化物 (即 [Ga(OH)4]− )
面临问题
通过考察NVS001在溶剂标样和175Lu-NVS001加标血样 (250ng/mL) 的响应,并未发现175Lu-NVS001向NVS001的转化,表明Lu-DOTA配合物稳定性良好
对只含66Ga-NVS001加标的空白血样采用甲醇/乙腈 (50:50, V/V) 提取分析,观察到明显的NVS001峰(如Figure S-1-A所示);然而对于只含66Ga-NVS001的溶剂标样,即使采用相同的提取步骤,却并未观察到该现象,表明66Ga流失更大可能是由于基质中存在的金属离子
解决方案
向内标工作液和蛋白沉淀试剂加入10 µM Na2EDTA,同时加入0.1%甲酸以避免66Ga的氢氧化物形成,如Figure S-1-B所示,66Ga-NVS001加标的空白血样提取后分析可观察到NVS001峰响应出现10倍降低,但是,其峰面积仍高于对应LLOQ的20%
进一步优化:
1)小体积异丙醇/丙二醇 (50:50 [V/V])加入到蛋白沉淀后的上清液以避免吹干;
2)将氮吹温度从40℃降至30℃。经过优化,如Figure S-1-C所示,NVS001峰未再检出
简而言之,EDTA不仅在LC-MS/MS流动相,而且在样品前处理鳌合基质和系统中的游离金属离子方面发挥重要作用;同时,维持酸性环境体系和优化氮吹条件,都对在样品提取过程中消除内标 66Ga-NVS001中Ga的流失具有重要意义。
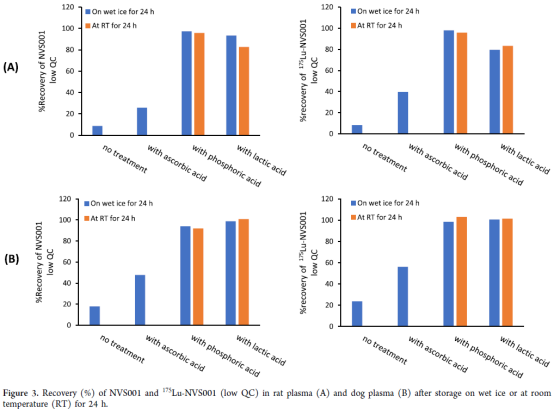
分别考察冰袋保存的QC样本低浓度(1.5 ng/mL) 和高浓度(190 ng/mL) NVS001 and 175Lu-NVS001的24h稳定性
低浓度(1.5 ng/mL) QC样本在冰袋保存24h后分析, NVS001 和 175Lu-NVS001在大鼠血浆和犬血浆的回收率分别只有8%和20%,低浓度(190 ng/mL) 并未观察到此现象,同时,校准曲线药品低浓度也出现偏低而影响线性的情况
由于多肽部分和进样小瓶及96孔板的非特异性吸附,或者与生物基质中内源性蛋白的结合,从而在样品转移和蛋白沉淀过程中出现待测物的损失
然而,低吸附进样小瓶和96孔板的使用并未改善低浓度样品的回收率问题
进一步考察样品管转移的影响:将含NVS001 和 175Lu-NVS001各4 ng/mL的样品依次在样品管间转移,每次转移前先涡旋1min,然后在冰袋保存5min以保证吸附,LC-MS/MS分析结果如Figure S-2所示,未有明显非特异性吸附
样品和内源性组分的吸附干扰考察:低浓度QC样本分别用抗坏血酸、磷酸和乳酸处理,然后置于冰袋和室温环境下24h,结果显示,抗坏血酸处理回收率(30-60%),磷酸或乳酸处理回收率(80-100%)。综合评估,血浆样本采用20%磷酸溶液按20:1(V/V)进行处理

从文献所报道的整个方法开发过程可以看到,该LC-MS/MS生物分析方法具有高选择性和高灵敏度的优点,能够基于25μL样品体积的条件下在0.5-250ng/mL浓度范围内用于同时测定大鼠和犬血浆中的游离配体(NVS001)和冷药(175Lu-NVS001)。同时表明向流动相中添加螯合剂EDTA可以显著提高游离配体NVS001的灵敏度,同时最大限度避免了NVS001与样品基质中的金属离子(例如K)形成螯合物影响分析结果。另外,向包括内标工作液、蛋白沉淀剂和复溶液在内的众多溶剂中引入EDTA和甲酸有助于最大限度地减少样品提取过程中内标66Ga的流失;同时采取相对温和的氮吹条件可进一步避免66Ga的流失。而用1%磷酸预处理血浆样品则能有效防止低浓度下待测物与内源性蛋白质结合而导致的结果“不稳定性"发生。此外,在蛋白沉淀剂中加入一定体积的丙酮也有助于获得一致的内标响应。更多的研究也表明,该LC-MS/MS工作分析流可扩展至其他放射性配体药物在生物样品中的的定量分析,从而支持临床前RLT药物的开发。
站在不同的视角来看,除了从所使用的溶剂和流动相中添加EDTA来避免上述文献中所遇到的分析问题,惰性的仪器管路以及惰性的色谱柱柱管及筛板(例如钛合金材质)是不是可以从另外一个维度来优化和解决这类问题呢,再延展到具有放射性的热药的分析,普通的不锈钢色谱柱和钛合金材质的色谱柱在进样具有放射性的药物的分析过程中,柱管内表面是否会发生不一样的变化,继而影响到峰形、回收率等分析结果呢,相信随着更多关于放射性核素偶联药物的研究进展,我们对于核药色谱分析所遇到的难题会逐渐解开。
关于钛合金材质色谱柱



LC−MS/MS Bioanalysis of Radioligand Therapeutic Drug Candidate for Preclinical Toxicokinetic Assessment. Anal. Chem. 2023, 95, 10812−10819.